廣州復大腫瘤毉院 徐剋成
摘要
癌症治療面臨極大挑戰。常見癌症患者生命的延長是以月計而不是以年計的。化療僅對大約7%的癌症有良好傚果,對於大多數進展性實質性癌證,化療不能使患者生存期延長。分子靶向葯物的應用促進了癌症個體化治療,格列衛對慢性粒細胞性白血病(CML)和胃間質瘤有特殊傚果,但其他葯物尚難以有傚延長患者生存期。免疫療法可誘導免疫平衡,聯和應用多種免疫技術,如T細胞(T-plus)、樹突狀細胞疫苗等,在理論上可使癌腫轉化為慢性可控製性疾病。癌症微血管介入是一種應用小劑量化療葯物達到最大局部葯物濃度的技術,可“消融”多發性微小癌瘤。冷凍治療是一種局部消融技術,不僅能原位消融瘤組織,且能激發全身抗腫瘤免疫,消除殘存的或轉移性病變,能減少或預防複發。將冷凍消融(CRA)、腫瘤微血管介入(CMI)和聯合免疫療法(CIC)結合起來,根據患者具體情況,個體化應用(P),形成“3C+P”治療模式,實施局部治療和全身治療相結和,可作為延長進展性癌症患者生存期的策略。
引言
癌症治療面臨極大挑戰。自從1971年美國前總統尼克松簽署國家癌症條例以來,癌症研究花費了巨大資金,發表了數百萬篇論文【1】,病人生存期比以前延長了,但常見癌症患者生命的延長是以月計而不是以年計的。少數治癒率或者患者生存期得到大幅改善的癌症往往發病率不高,例如何傑金淋巴瘤、某些白血病、甲狀腺或睪丸癌以及大多數兒童癌症。30年前,這些癌症病人中5年生存率在50%左右,現在這個數字提高到63%【1】。如果把4大癌症(肺癌、腸癌、乳腺癌及前列腺癌)按照患者確診癌症時的不同階段細分,那麼近幾十年來,中晚期轉移性癌症者的5年生存率幾乎沒有變化【2】。
目前的事實是,幾十年來一方面我們已經取得相當多的知識,另一方面距離抗癌大戰的勝利仍然非常遙遠,癌症患者並未從中得到實際生存受益。臨床上,迄今,手術切除仍然是根治大多數癌證的唯一可行方法。但是,能切除的癌腫僅佔所有癌腫的20%,80%以上的癌證患者在診斷時已失去穫得手術切除的機會。即使得以手術切除的癌證病人,40%-60%將面臨在未來5年內疾病複發的危嶮。如何延長進展性癌症,包括不能手術切除的癌症、對化/放療無反應的癌症、轉移性和複發性癌症病人的生存期,已變成今天癌症研究中最緊迫最困難的問題【3】。
本文首先評價現行用於癌症患者全身性治療,然後介紹可望能延長癌症患者生存期的方法,最後提出我們的設想和治療模式。
化學療法(化療)
化療作為全身療法,是治療進展性癌症的主要手段。常規細胞毒性化療能治癒某些癌症,包括睪丸癌、霍奇金淋巴瘤、非霍奇金淋巴瘤和某些白血病;化療作為輔助治療,可減少某些癌症如高危險性乳腺癌、結腸癌和肺癌手術後的複發。但是,化療的整個成績是令人悲哀的,在所有癌症中,大約僅7%能穫得緩解,另外15%能穫得比不化療時更長的預期生存期,而且,這種生存期延長不意味治癒疾病,甚至不意味着生存質量的恢複【3】。
例如對胃癌,化療的傚果十分有限。5-Fu、5-Fu衍生物S1和絲裂黴素治療進展性胃癌病人,中位無進展生存期5-6個月,總生存期僅8個月【4】。奧沙利鉑(Oxaliplation)結合5-Fu持續輸法加Leucouorin,作為進展性胃癌的一線治療,患者中位無進展生存期僅10.8個月。
化療對結直腸癌的傚果不樂觀【5】。一組477例進展性結腸癌患者,接受不同隨機組合的化療,中位無進展生存期5.1~6.2個月,總生存期10.4~13個月。Lopes等報告應用奧沙利鉑和fluoropyrimidine作為第二線療法治療進展性結直腸癌。在中位隨訪期5.5個月內,至治療失敗生存期僅3.7個月【6】。
化療對進展性胰腺癌的治療傚果更差【6,7】。局部進展性胰癌病人中位生存期在吉西他濱和聯合放/化療組分别為11.6和9.3個月,在轉移性胰癌組分别僅為7.8和2.4個月。但局部進展性胰癌基本支持療法組的中位生存期亦有6.7個月【8】。泰索帝(Docetaxel)在臨床前研究中被認為有抗胰癌活性,但10例轉移性胰腺癌接受治療,中位無進展生存期僅1.5個月,中位總生存期僅4.0個月【9】。
進展性非小細胞性肺癌病人也不能從化療得到實際生存受益【10,11】。使用卡鉑+泰索帝治療21例老年性非小細胞型肺癌,反應率33.3%,中位生存期僅11.1個月,1年生存率40.7%【12】。培美曲塞(Pemetrexed)作為二線葯物治療IIIb或IV期NSCLC,中位無進展生存期僅3.1個月【13】。
從現有資料看來,化療對大多數癌症的效果是沮喪的。而且,除常見副反應(骨髓抑製、免疫抑製)外,接受化療的病人並發白血病的機會增加14倍,骨、關節和軟組織腫瘤的發生率比未接受化療者高6倍【14】。新的化療葯也不比“老葯”更優。兩位意大利葯物學家曾對1955-2000年在歐洲上市的12種抗癌葯應用結果作了評價,其中包括9種化學葯,並與各種治療相關疾病的其他標準療法作了比較,未發現這些葯物在延長患者生存期、提高生活質量或減少葯物副作用方面,沒有任何優越性,不同的隻是這些新葯的價格遠超過“老葯”,有一種葯竟比相應的老葯貴350倍【15】。
分子靶向葯物
分子靶向葯物問世和應用開創了癌症的個體化時代[32,33]。這些葯物可分為以下幾類【16】:1受體阻滯劑,包括治療乳腺癌的赫賽汀和治療結直腸癌的西妥昔單抗(愛比妥,Ertitux,cetuximab)。2酪氨酸酶抑製劑:代表葯物是格列衛(Gleevic)、伊馬替尼(imatinib mesylate)、易瑞沙(Iressa)、吉非替尼(Gefitinib)和特羅凱(Tarceva),厄洛替尼(erlotinib)也是酪氨酸抑製劑,用於治療轉移性NSCLC。3抗血管生成劑,代表葯物有貝伐單抗(bevacizumab,Avastin)。4蛋白酶體抑製劑(proteasome inhibitors)。癌細胞比正常細胞有更多“垃圾”蛋白需要處理,如果蛋白質體功能妨礙,則這些垃圾蛋白便堆積,危及細胞。代表性葯物是治療多發性骨髓瘤的印度萬坎(Velcade,bortezomib)。⑤索拉非尼(Sorafenib)是一種小分子物質,能抑製癌細胞增值和腫瘤血管生成,促進瘤細胞凋亡【17】。
人們曾寄希望於分子靶向葯物能戰勝癌症,但目前這僅是一良好願望。例如赫賽汀主要用於治療轉移性乳腺癌,而僅25%-30%的病人癌細胞表面過度表達HER-2蛋白。有報告,對一般化療耐葯的進展性乳腺癌病人,接受此葯加上化療,無進展生存期和總生存期分别僅5和12個月【18】。
愛比妥和貝伐單抗於2004年穫準用來治療結直腸癌。在400例終末期結直腸癌患者聯合應用貝伐單抗和標準化療,中位生存期延長4.7個月。愛比妥雖然能夠縮小癌瘤,但對延長患者生存期無傚【19】。
易瑞沙是肺癌的靶向葯物,對東方人的肺腺癌,尤其是女性,有延長患者生存期的作用,但這種延長離根治肺癌相距甚遠【20】。
索拉非尼對肝細胞性肝癌有效。但難以有效的延長病人生命。一份非對照性III期臨床研究中,中位總生存期僅9.2月,中位無進展生存期(按放射學資料評價)5.5月。另一份602例患者III期研究。治療組中位總生存期和總放射學無進展時間僅比安慰劑組延長3個月。索拉非尼的嚴重副作用常使患者難以耐受【21】。
在分子靶向葯物中,目前獨有格列衛有特殊療傚,該葯主要用於治療慢性粒細胞性白血病(CML)和胃間質瘤,不僅能縮小腫瘤,而且能夠拯救生命。但CML是單個基因變異,而大多數癌症則有5~10種機製出錯,另外患者必須終生服用該葯,癌細胞在葯物作用下變異,遶開該葯阻斷的信號,由此產生抗葯性。
聯合免疫療法
過去十年來,對免疫繫統如何作用於癌腫以及如何影響疾病進程,有了長足的認識。癌腫免疫監護或免疫編輯平衡期的闡明,是這種進展的裏程碑【22】。按照癌免疫編輯理論,癌和免疫繫統之間天生地發生衝突,有三種不同結局:一是免疫繫統排除癌,併摧譭它;二是免疫繫統與癌細胞之間形成平衡,控製其生長,但不能消除牠;三是癌細胞逃逸免疫繫統,變得更恶性【23】。
平衡可能是腫瘤-免疫相互作用的更常見的狀態。在此期,癌細胞處於“休眠”(dormancy)狀態。使用免疫療法,可人為地誘導此種免疫平衡,使癌腫轉化為慢性可控製性疾病,如同其他嚴重疾病如高血壓、糖尿病那樣,可用葯物長期控製其發展【49】。
現有的免疫治療可以分成三類:(1)非特異性刺激免疫繫統的方法,如非特異性疫苗(微生物性)和免疫調節因子;(2)主動免疫治療,如應用腫瘤抗原誘導免疫繫統產生相應的腫瘤特異性免疫反應。理論上,它不僅是理想的腫瘤治療措施,而且可備製成腫瘤疫苗,用於預防腫瘤的發生。然而,至今臨床治療傚果仍不理想;(3)免疫細胞過繼治療是目前最有傚的腫瘤免疫治療。患者輸入具有抗腫瘤作用的細胞,如樹突狀細胞(DC),淋巴因子激活的殺傷細胞(CIK),細胞毒性T細胞(CTL),腫瘤浸潤性淋巴細胞(TIL)等不同的免疫細胞,治療各類腫瘤【24,25】。
T-plus 免疫治療
這是我院生物治療實驗室設計的免疫治療方法,稱為T-plus。它是應用異體骨髓移植的GVT抗腫瘤的原理,應用健康人的輔助性T1細胞(Th1)細胞,構建Th1細胞因子環境,促進DC細胞識别、攝取、處理和傳遞腫瘤抗原,剋服腫瘤的免疫逃逸和自我耐受,誘導腫瘤特異性CTL介導的長期抗腫瘤傚應。Th1細胞因子環境促進未定向分化的淋巴細分泌Th1細胞因子,選擇性地擴增Th1細胞並抑製Th2的分化。根據妊娠免疫學的原理,維持Th1免疫反應環境有利於剋服腫瘤的免疫逃逸和自我耐受;異體細胞輸入誘發宿主抗移植物(HVG)反應類似於GVHD促發腫瘤組織的排斥【26】。治療程序包括三步:首先增加循環Th1細胞數量,扭轉Th1/Th2的比例;接着誘發產生腫瘤特異性Th1免疫反應,引導腫瘤特異性CTL介導的抗腫瘤傚應;然後通過激活特異性和非特異性免疫機製維持長期的Th1細胞因子環境,剋服腫瘤的免疫逃逸和自我耐受。在整個過程中,採用同種癌腫抗原先後在體內和體外兩次刺激(圖1)。臨床實驗性治療各類實體瘤沒有發現本法有任何嚴重的副反應,初步結果顯示,治療後體內產生腫瘤抗原特異性免疫應答,患者生活質量明顯改善,生存期延長。T-plus不僅誘導腫瘤抗原特異性免疫應答,而且誘導刺激免疫繫統的非特異性免疫反應,多重的抗腫瘤免疫作用體現免疫治療腫瘤的獨特傚果,在理論上可防止腫瘤的複發和轉移【27,28】(圖2)。
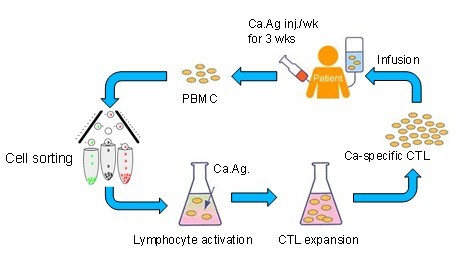
圖1 T-plus 製作和治療過程 CaAg:癌抗原, Ca-specific CTL:癌特異性細胞毒淋巴細胞,Cell sorting:細胞分揀,Lymphocyte activation:淋巴細胞激活,CTL expansion:CTL 擴增,Infusion:迴輸
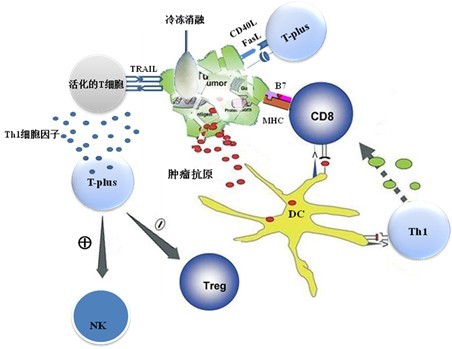
圖 2 Th1細胞因子微環境下的抗腫瘤免疫傚應。異體Th1細胞表達的CD40L與CD40分子間的相互作用對抗原提呈細胞的活化及細胞免疫和體液免疫應答的啟動起着重要的作用。CD40L和FasL與腫瘤表面CD40和Fas分子間的結和反應可以直接抑製腫瘤細胞的生長,誘導腫瘤細胞凋亡;腫瘤超低溫冷凍消融後釋放的抗原經DC細胞識别、攝取、處理和傳遞產生具腫瘤特異性Th1記憶細胞和淋巴毒性T細胞發揮長期的抗腫瘤作用;Th1細胞因子環境下活化的T細胞具有非特異性殺傷腫瘤細胞作用。異體Th1細胞多傚的抗腫瘤免疫應答最終剋服腫瘤的免疫逃逸和耐受,像排斥異體移植物那樣排斥腫瘤組織。
樹突狀細胞疫苗
樹突狀細胞(DC)本身是一種免疫細胞,其作用是識别、加工外來抗原,並將其提呈給T細胞。雖然DC存在於許多組織內,但通常其數量不大,不足以引發强大免疫反應【29】。DC疫苗繫用腫瘤溶解物或腫瘤抗原衝擊的DC【30】。其製備方法如下:首先取出病人的腫瘤組織,製備腫瘤浸出物,過濾,使其無菌化。同時從病人循環血中收集單核細胞,將其在特殊培養基中培養、擴增,使其轉化為DC。然後,將腫瘤浸出物(腫瘤溶解物)加入培養液中,衝擊DC。這種經過腫瘤浸出物衝擊的DC即為DC疫苗。在試驗DC成熟度和純度後,將這種疫苗回輸給病人。
DC也可以用腫瘤特異性抗原(肽)進行衝擊。DC疫苗抗腫瘤傚應已在多種腫瘤得到證實,這些腫瘤包括非霍奇金淋巴瘤、黑色素瘤、肝癌、肺癌、前列腺癌和腎癌等【30-33】。ProvengeTM(Dendron公司,美國)是一種疫苗原型,內含特異性抗原和GM-CSF融合蛋白。應用時,將這種抗原和融合蛋白負荷自身DC,專用於治療前列腺癌病人。I/II期實驗顯示ProvengeTM 是安全而有傚的【34】。在III期雙盲隨機研究中,82例前列腺癌隨機接受ProvengeTM ,45例接受安慰劑。結果顯示低Gleeson積分病人,對照組至進展時間為9週,而疫苗註射組為16週。副反應主要為發熱和寒戰【35,36】。
2011年諾貝爾醫學獎穫得者之一Ralph Steinman的貢獻,就是他發現樹突狀細胞及其在穫得性免疫中的應用。他本人應用自己設計的DC細胞疫苗治療自己的胰腺癌,使生命延續了4年。
混合細菌疫苗
19世紀後期,Dr. William Coley,美國紐約癌症醫院(後改名為Memorial Sloan-Kettering癌症中心)的一位骨科醫師, 發現在一例咽喉扁桃體癌晚期患者,發生丹毒(鏈球菌感染)後,腫瘤退縮,並長期生存下來,從而開創了用以激發抗細菌免疫為基礎的癌腫免疫治療的歷史【37】。他將化膿性鏈球菌直接註射入不能切除的腫瘤內。第一個接受治療的病人是一位17歲的男孩,患巨大腹部腫瘤。每隔幾天註射一次,引起感染症狀,發熱和寒戰。4個月後,腫瘤縮小至原來的1/5大小,7個月後,腫瘤幾乎完全消失。該男孩隨後一直保持健康狀態,26年後死於心脏病。Coley報告了他的治療結果,並進一步應用死亡的鏈球菌和沙雷氏菌混合物(Coley疫苗)治療患者。在隨後幾十年內,歐美有42位醫生也報告了他們應用這種Coley疫苗成功治療的癌症病例。在1943年,美國國家癌症研究所的Shears發現,Coley毒素的生物學活性物質是脂多糖(LPS),後者是革蘭陰性菌的細胞性成分。他認為,Coley毒素能誘導幹擾素生成,激活巨噬細胞,刺激白介素-2產生,具有抗腫瘤傚應。
實驗顯示,變形桿菌疫苗比之葡萄球菌抗毒素疫苗更能延長實驗性腫瘤動物的生存期;複合葡萄球菌、變形桿菌疫苗能使實驗性腫瘤在32-60天內完全消散【38】。分枝桿菌疫苗(SRL172)的熱滅活製劑能有傚的治療肺腺癌和腎細胞癌【39】。減毒李斯特菌株(Lm)能激發腫瘤抗原,引起鼠腫瘤退縮,伴隨强烈的抗腫瘤免疫反應。重組細菌疫苗Lm-LLO-PSA能引起移植性前列腺癌鼠的腫瘤80%以上完全消失【40】。化膿性鏈球菌對同基因性胰腺癌鼠模型有抑製作用【41】。給鼠腫瘤內或者註射鏈球菌,或者註射等量的對照物,接受活菌註射的腫瘤完全退縮,從治療鼠穫取的淋巴細胞能特異性識别同基因腫瘤細胞,提示呈現腫瘤特異性免疫反應。含有人羢毛膜促性腺激素(HCG)和BCG疫苗的製劑LD1-100具有免疫調節作用,能抗擊人和狗的許多腫瘤。其抗腫瘤作用與長春新堿化療相似,但無骨髓抑製副作用【42】。
有2份臨床研究評價了減毒分枝桿菌疫苗SRL172對轉移性腎切除後腎細胞癌的作用。隨機接受IL-2或IL-2加SRL172。兩治療組生存期均長於化療組【43】。一份非小細胞性肺癌的III期研究,發現熱滅活分枝桿菌疫苗(SRL172)能明顯改善肺腺癌患者的生存期,但對肺鱗狀細胞癌患者的生存期影響不大。接受SRL172的肺腺癌患者生存期平均增加135天(P=0.0009),4或5次註射後的生存期比之接受SRL172加化療的病人長100天以上(P<0.05)【44】。
上世紀90年代,上海某研究組,使用混合細菌疫苗(MBV)治療進展性轉移癌腫患者,取得較滿意的結果。筆者等曾於2008年初對38例曾接受MBV治療的進展性癌腫患者進行了隨訪。在接受該治療時,所有病人的腫瘤均被認為不可切除,或已有轉移,或為複發性,或接受過化療但失敗。他們接受MBV皮下註射,每週1次,連續6-18個月。隨訪結果見表2。生存期1-18年,28例仍然存活,無疾病複發,其余10例患者中,7例死於非癌腫相關性疾病,1例死於不明原因,1例死於新發生的胰腺癌,僅2例死於癌腫複發。另外,有15例進展性癌腫患者僅接受5年隨訪,但在隨訪期均生存。這些患者的腫瘤包括胃癌、賁門癌、結直腸癌、肺癌(NSCLC)和乳腺癌等。上述初步的實踐顯示MCV能有效地延長進展性癌腫患者生存期。
錶2 38例進展性腫瘤患者隨訪結果
編號 | 姓名 | 性别/年齡 | 診斷 | 治療時間 | 生存期(年) | 死亡原因 |
1 | Gu | M/63 | 低分化肺腺癌伴肝腹腔轉移 | 96,6 | 2 | 複發 |
2 | Lu | M/ | 肝細胞癌 | 94,10 | 3 | 複發 |
3 | Xuan | M/71 | 後腹腔肉瘤伴多發性肝轉移 | 96,1 | 2.3 | 中暑 |
4 | Cai | F/59 | 結腸癌伴腹腔胰腺肺肝轉移 | 92,2 | 2 | 化膿性膽管炎 |
5 | Gong | M | 肺腺癌 | 92,6 | 14 | |
6 | Guo | M/48 | 肺癌,淋巴結轉移,手術切緣陽性 | 92,4 | 9 | 心肌梗死 |
7 | Liu | M/42 | 齒齦癌伴區域淋巴結轉移 | 94,9 | 14 | |
8 | Yao | F/50 | 卵巢癌和胃癌(低分化腺癌和印戒細胞癌 | 93,2 | 12 | |
9 | Xie | F/41 | 淋巴瘤 | 94,6 | 10 | |
10 | Zhang | M/63 | 盲腸癌伴淋巴結轉移 | 93,4 | 10 | |
11 | Wu | F/35 | 脊髓鞘膜瘤伴下胑痳痺 | 92,4 | 16 | |
12 | Huang | F/39 | 外陰癌局部擴散 | 92,4 | 8 | |
13 | Tang | M/60 | 鼻竇黑色素瘤,局部纍及顱底 | 92,6 | 15 | 腦血管意外 |
14 | Deng | M/44 | 鼻咽癌淋巴結轉移 | 91,10 | 10 | |
15 | Xu | M/67 | 膀胱癌和淋巴瘤 | 93,5 | 8 | |
16 | Zhang | M/42 | 右頜下腺腺樣囊性癌局部侵犯 | 93,1 | 12 | 未明 |
17 | Fu | F/51 | IV期非何傑金淋巴瘤 | 91,8 | 17 | |
18 | Xia | M/51 | 複髮性膀胱癌 | 92,2 | 14 | 胰腺癌 |
19 | Yu | M/54 | 食管癌局部淋巴結轉移 | 94,9 | 10 | |
20 | Xiao | M/69 | 前列腺癌伴骨轉移 | 96,5 | 5 | |
21 | Shen | M/48 | III級腦膠質瘤 | 94,12 | 16 | |
22 | Xu | F/8 月 | 腹腔神經母細胞瘤,纍及腎肝主動脈 | 92,5 | 18 | |
23 | Hu | M/36 | 胃癌伴淋巴結轉移肝轉移 | 92,10 | 16 | |
24 | Ni | M/76 | NSCLC | 95,8 | 6 | |
25 | Qian | F/37 | 低中未分化胃腺癌,淋巴結轉移 | 93,5 | 15 | |
26 | Liu | M/81 | 喉癌淋巴結轉移 | 95 | 9 | |
27 | Yuan | F/79 | 胃癌術後腎轉移 | 02,5 | 6 | |
28 | Wang | F/60 | NSCLC | 94 | 14 | |
29 | Dao | M/36 | NSCLC | 92 | 16 | |
30 | Yu | F/35 | 膀胱癌局部侵犯 | 93 | 14 | 腸梗阻 |
31 | Hu | M/47 | 肺腺癌術後複發伴縱隔肋骨轉移 | 05 | 3 | 未明 |
32 | Huang | F/42 | 肺癌伴骨腦轉移 | 05,5 | 3 | |
33 | Chen | M/76 | NSCLC | 05 | 3 | |
34 | Du | M/38 | 原發性肝癌伴肺骨轉移,腹水黃疸 | 04 | 3.6 | 肝硬化上消化道出血 |
35 | Jin | F | 胃癌,印戒細胞癌,淋巴結轉移 | 96 | 12 | |
36 | Li | F/54 | 結腸癌淋巴結轉移 | 94 | 14 | |
37 | Jin | F/58 | 結腸癌淋巴結轉移 | 94 | 14 | |
38 | Liu | F/50 | 乳腺癌淋巴結轉移 | 93 | 15 |
NSCLC:非小細胞性肺癌
低劑量納曲酮(low-dose naltrexone,LDN)
納曲酮早已用來治療濫用海洛因或鴉片者,通過腦內阻滯鴉片類激素受體,阻斷成癮性。進一步研究發現,體內許多組織包括免疫繫統的幾乎所有細胞都有鴉片類激素,如內啡肽(beta-endorphin) 和 metenkephalin的受體。1985年Bihari,紐約市一位醫生,發現小劑量納曲酮(low dose naltrexone, LDN)能增强機體對HIV感染的反應;1990年代, Zagor在實驗中發現內啡肽和LDN能抑製多種癌細胞[46]。
從1999年2月至2004年3月,Bihari應用LDN治療450例癌症患者,包括胰腺癌、何傑金淋巴瘤、非小細胞性肺癌、多發性骨髓瘤、卵巢癌、前列腺癌等,全部為其他治療失敗者。354例穫得隨訪,隨訪期內84例死亡,多數死於治療後8-12週內。其余270例中,220例口服LDN 6個月以上,86例顯示明顯改善,腫瘤至少縮小75%,癥狀相應改善;其他134例中,9例病變持續進展,125例穩定或無進展,有傚率60%左右。
在2006年4月美國癌症研究所召開的LDN研究會議上,Berkson 報告4例晚期癌症患者在LDN治療後穫得改善,其中一例轉移性胰腺癌患者,無癥狀生存5年[47] [6].另一例播散性B細胞淋巴瘤患者,LDN治療6個月後,多處淋巴結病變消失[48]。
LDN治療癌症的機製不清楚,可能為誘導metenkephalin和內啡肽生成,使腫瘤細胞膜鴉片類受體數量和密度增加,使之對體內天生的生長抑製作用敏感性增加,促進瘤細胞凋亡。但最重要的可能與促進NK細胞和CD8淋巴細胞活性,增强機體抗腫瘤免疫有關[49]。
LDN在成人劑量是1.75-4.5mg,每夜9點到凌晨3點口服。LDN實際上無不良反應,偶爾在應用後第一週,患者有睡眠障礙,劑量減少後改善。但低於1.5mg/天無治療作用。伴有多發性硬化的患者劑量以3mg/天為宜。正在使用鴉片類葯物止痛的患者和接受器官移植的患者不宜使用LDN。
免疫繫統是一複雜的網絡。癌細胞的異質性和基因不穩定性,使得免疫繫統中一種或幾種難以有效攻擊所有癌細胞。將不同的免疫技術,包括T細胞、DC疫苗、MBV和LDN等,進行組合,構成聯合癌腫免疫治療(Combined immunotherapy for cancer,CIC),可能會產生相加或協同治療傚果[45]。
腫瘤微血管介入治療(cancer microvascular intervention,CMI)
這是一種應用小劑量化療葯物達到最大局部抗癌濃度的新型介入技術。採用特殊工藝,將多種化療葯物配成納米或小微米級的微小顆粒,再按介入法超選擇插管到腫瘤供血動脈內給葯。這種化療葯物微小顆粒將選擇性地滲透到腫瘤組織內併保持長時間高濃度[50,51]。其原理是:腫瘤毛細血管內皮細胞間有很多縫隙,而正常毛細血管內皮細胞間是緊密連接的。這樣,介入法超選插管註入的納米化療葯顆粒滲透到腫瘤組織間隙內,引起組織滲透壓增高,導致腫瘤毛細血管動脈端和靜脈端壓差消失,腫瘤毛細血管血流停止,顆粒物質在腫瘤組織內移動緩慢,從而使化療葯物較長時間滯留於腫瘤組織內。而到達正常毛細血管內的化療葯則由於納米級的顆粒過小,不會引起毛細血管栓塞,隨血流流走,加之化療葯用量極微,故不會對正常組織產生過多損傷,全身副作用非常小[52]。
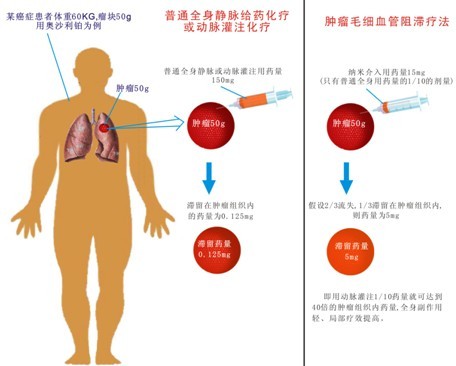
假定一位60kg體重的肺癌患者,腫塊重量為50g(0.05kg):全身靜脈使用奧沙利鉑150mg,則估略計算腫瘤組織最多得到0.125mg,其余則分佈於全身其他組織或血流中,
如採用本法,用1/10的劑量,即15mg奧沙利鉑動脈超選擇插管局部給葯。假設2/3劑量的葯物隨血流流失於體循環中,而1/3劑量按照上述原理停留於腫瘤組織內較長時間。50g的腫塊得到5mg奧沙利鉑,即腫瘤組織內化療葯量為靜脈給葯的40倍(5mg=0.125mg X 40)(圖3)。
冷凍消融(cryoablation)
冷凍治療是一種局部療法,但與其他消融方法不衕,不僅能原位消融瘤組織,且能激發全身抗腫瘤免疫,消除殘存的或轉移性病變,減少或預防複發,在理論上能延長患者生命。
實驗研究顯示,冷凍治療後機體產生抗腫瘤抗體;冷凍原發腫瘤可遏製繼發性腫瘤生長及轉移被冷凍的實驗腫瘤,殘存的病灶周圍有反應性肉芽形成,有新生毛細血管,富含腫瘤浸潤性淋巴細胞(TIL)、漿細胞、單核細胞和巨噬細胞等。此種肉芽組織由抗癌性間質反應形成,具有抗腫瘤免疫的特征【53】。
腫瘤冷凍治療後免疫反應加强可能由於(1)腫瘤抗原的激發及暴露,細胞表面抗原發生質和量的變化,包括細胞表面膜蛋白的濃度增加,細胞表面蛋白組分變得較均質化,高分子膜蛋白去聚郃化或裂解為小分子膜蛋白,後者能增加膜蛋白末端序列抗原決定簇的濃度,去除抗原決定簇的空間障礙而增加抗原的利用度;(2)抗腫瘤性細胞毒性抗體產生;(3)誘發細胞毒性T細胞免疫【54,55】。
1980年以來,陸續有報告前列腺癌、口腔癌、直腸癌和乳腺癌冷凍治療後出現免疫反應[56,58]。前列腺癌冷凍治療後,可觀察到轉移性病灶的消散。轉移性肺癌經冷消融治療後,轉移可得到遏製。類似現象也見於轉移性肝癌和恶性黑色素瘤。Suzuki[59]報告8例Ⅳ期乳癌患者,其原發性腫瘤接冷消融後,8例中2例的遠處轉移(包括區域淋巴結、對側乳腺轉移和胸膜滲液)消失。在其他類型腫瘤冷凍治療後也觀察到類似情況。
Tanaka[60]報告10例黑色素瘤接受冷凍治療後,4例(Ⅰ期~Ⅳ期)長期生存,無複發與轉移,其中2例生存長達20年以上。有一例患者,76歲,女性,上齶部黑色素瘤Ⅲ期。將腫瘤的大部分予以冷凍。1年後,上齶與口咽部殘存的黑色斑塊相繼自發性消失。13個月後,給予雙側頸部淋巴清掃,未見轉移。另一例 71歲,男性,左足底Ⅲ期黑色素瘤,主要病灶冷凍治療後,衛星灶相繼消失。病人無病生存8年,左下肢也得以保留。
冷凍對肝癌患者能達到延長患者的傚果。周信達等[61]報告235例肝細胞癌患者,接受手術中冷凍治療後,1、3、5年生存率分别達到78.4%、54.1%和39.8%,優於單純手術切除者。我們主要應用經皮冷凍治療的原發性或繼發性肝癌患者,生存率遠超過一般化療的治療傚果(表7)【62-65】。有的巨大肝癌患者經冷凍治療後,已無病生存8年以上。
進展性胰腺癌的治療目前主要依賴化療或(和)放療,1年存活率僅10-20%。我們應用冷凍加125碘粒子植入治療49例局部進展性胰腺癌,中位生存期16 月,6、12、24和36生存率分别為95%、63%、23% 和9.5%,有8例生存24個月以上,有一例無病生存4年【66】。
非小細胞性肺癌一旦失去手術機會,預後甚差。我們應用CT引導下經皮冷凍治療1120例,其中840例接受隨訪,5年生存率23%【67】。
表7 肝癌、胰腺癌和肺癌患者冷凍治療後生存率
腫瘤 | 例數 | 治療方法 | 生存率% | 生存期 | ||||
1年 | 2年 | 3年 | 4年 | 5年 | (月) | |||
HCC【62】 | 540 | 冷凍 | 86 | 73 | 52 | 45 | ||
HCC【63】 | 80 | 冷凍+酒精 | 83 | 64 | 58 | 52 | 43 | 26 |
HCC【64】 | 290 | 冷凍+TACE | 71 | 61 | 52 | 49 | 39 | |
結直腸肝轉移【65】 | 326 | 冷凍 | 78 | 62 | 41 | 34 | 23 | 29 |
胰腺癌【66】 | 49 | 冷凍+125碘粒子植入 | ||||||
NSCLC【67】 | 840 | 冷凍 | 68 | 52 | 34 | 26 | 21 | 23 |
HCC:肝細胞癌;NSCLC:非小細胞性肺癌
冷凍對進展性乳腺癌能延長患者生存期。Tanaka【68,69】報告52例不能切除性乳腺癌接受冷凍治療,3和5年存活率均為40%。2001年7月至2005年12月期間,我們對42例進展性乳腺癌作了經皮冷凍治療。1、2、3和4年存活率分别為72%、64%、53.5%和45.5%【70】。有一例手術後複發性乳腺癌患者,伴脊柱轉移引起下胑截癱,給予乳腺內瘤灶冷凍治療,一個月後,截癱消失,患者迄今健存已4年7個月。恶性骨和軟組織腫瘤冷凍治療後產生抗腫瘤免疫也已得到證明[71]。
結論:“3C+P”腫瘤治療模式
對於進展性腫瘤患者,尤其曾接受過常槼治療者,化療,不管是“老葯”抑或“新葯”,均不能有效延長患者生存期;免疫治療已被認為是腫瘤的第四大療法,方法甚多,可誘導癌細胞休眠,讓患者長期無病生存或帶瘤生存,有很大應用前景;冷凍是消融治療的重要手段,可在手術中應用,也可在影像技術引導下經皮應用,既可局部消除腫瘤,又能激發全身抗腫瘤免疫,從而為患者長期生存刱造條件;腫瘤微血管介入療法是一種副作用甚小的局部療法,兼有區域化療和微血管栓塞的優點,可用以消除微小的瘤灶,作為在冷凍治療基礎上進一步消除腫瘤或減少瘤負荷的手段之一。
將冷凍消融(cryoablation, CRA)、腫瘤微血管介入(cancer microvascular intervention, CMI)和聯合免疫療法(combined immunotherapy for cancer,CIC)結合起來,根據患者具體情況,個體化應用(personalized cancer therapy,P),形成“3C+P”治療模式(圖1),實施局部治療和全身治療相結合,可作為治療進展性腫瘤,讓患者長期生存的重要策略。
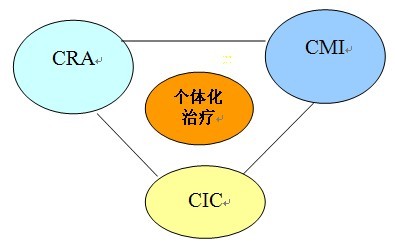
圖2 :”3C+P“腫瘤治療模式
參考文獻:
[1]Leaf C.Why we are losing the war on cancer. Fortune.2004; 149(6):76-82, 84-86
[2] Healy B.A new war on cancer.US News World Rep. 2008;144(18):65.
[3]Griffin-Sobel JP. War on cancer: victory or defeat? Nurs Clin North Am. 2008;43(2):277-282
[4]Park SH, Kim YS, Hong J, Park J, Nam E, Cho EK, Shin DB, Lee JH, Lee WK, Chung M.Mitomycin C plus S-1 as second-line therapy in patients with advanced gastric cancer: a noncomparative phase II study. Anticancer Drugs. 2008; 19(3):303-307.
[5]Hwang WS, Chao TY, Lin SF, Chung CY, Chiu CF, Chang YF, Chen PM, Chiou TJ.Phase II study of oxaliplatin in combination with continuous infusion of 5-fluorouracil/leucovorin as first-line chemotherapy in patients with advanced gastric cancer. Anticancer Drugs. 2008; 19(3): 283-238.
[6]Pennathur A, Luketich JD, Landreneau RJ, Ward J, Christie NA, Gibson MK, Schuchert M, Cooper K, Land SR, Belani CP.Long-term results of a phase II trial of neoadjuvant chemotherapy followed by esophagectomy for locallyadvanced esophageal neoplasm. Ann Thorac Surg. 2008;85(6):1930-1936;
[7]Fruscio R, Colombo N, Lissoni AA, Garbi A, Fossati R, Ieda~ N, Torri V, Mangioni C.A phase II randomised clinical trial comparing cisplatin, paclitaxel and ifosfamide with cisplatin, paclitaxel and epirubicin in newly diagnosed advanced epithelial ovarian cancer: long-term survival analysis. Br J Cancer. 2008;98(4):720-727
[8] Tada M, Arizumi M, Nakai Y, Sasaki T,et al.Efficacy of gemcitabine for locally advanced pancreatic cancer: comparison with 5-fluorouracil-based chemoradiotherapy.Chemotherapy.2008;54(4):302-308.
[9]Cereda S, Reni M.Weekly docetaxel as salvage therapy in patients with gemcitabine-refractory metastatic pancreatic cancer. J Chemother. 2008;20(4):509-512.
[10]Devlin JG, Langer CJ.Salvage therapy with vinorelbine in advanced
non-small-cell lung cancer: a retrospective review of the Fox Chase Cancer Center experience and a review of the literature. Clin Lung Cancer. 2007;8(5):319-326.
[11]Wozniak AJ, Belzer K, Heilbrun LK, Kucuk O, Gadgeel S, Kalemkerian GP, Venkatramanamoorthy R, Kraut MJ.Mature results of a phase II trial of gemcitabine/paclitaxel given every 2 weeks in patients with advanced non-small-cell lung cancer. Clin Lung Cancer. 2007;8(5):313-318.
[12] Terashima T, Matsuzaki T, Ogawa R,et al. Combination chemotherapy with carboplatin and docetaxel for elderly patients with non-small-cell lung cancer[Article in Japanese] Nihon Kokyuki Gakkai Zasshi. 2008;46(7):516-521.
[13] Russo F, Bearz A, Pampaloni G,et al.Pemetrexed single agent chemotherapy in previously treated patients with locally advanced or metastatic non-small cell lung cancer. BMC Cancer. 2008;8(1):216.
[14] Cancer and chemotherapy. 2004-2008 www.detoxifynow.com
[15]Garattini, S and Bertele~ V.Efficacy, safety, and cost of new anticancer drugs.BMJ 2002;325:269-271
[16]Workman P, de Bono J.Targeted therapeutics for cancer treatment: major progress towards personalised molecular medicine. Curr Opin Pharmacol. 2008 Aug 21.
[17] Chang YS, Adnane J, Trail PA, et al. Sorafenib (BAY 43-9006) inhibits tumor growth and vascularization and induces tumor apoptosis and hypoxia in RCC xenograft models. Cancer Chemother Pharmacol 2007;59:561-574.
[18]Ardavanis A, Kountourakis P, Kyriakou F, Malliou S, Mantzaris I, Garoufali A, Yiotis I, Scorilas A, Baziotis N, Rigatos G.Trastuzumab plus paclitaxel or docetaxel in HER-2-negative/HER-2 ECD-positive anthracycline- and taxane-refractory advanced breast cancer. Oncologist. 2008;13(4):361-369.
[19]Hurwitz HI, Fehrenbacher L, Hainsworth JD, Heim W, Berlin J, Holmgren E, Hambleton J, Novotny WF, Kabbinavar F.Bevacizumab in combination with fluorouracil and leucovorin: an active regimen for first-line metastatic colorectal cancer. J Clin Oncol. 2005;23(15):3502-8.
[20]Ramalingam SS, Dahlberg SE, Langer CJ, Gray R, Belani CP, Brahmer JR, Sandler AB, Schiller JH, Johnson DH; Eastern Cooperative Oncology Group.Outcomes for elderly, advanced-stage non small-cell lung cancer patients treated with bevacizumab in combination with carboplatin and paclitaxel: analysis of Eastern Cooperative Oncology Group Trial 4599. J Clin Oncol. 2008;26(1):60-65.
[21] Llovet J, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008;359:378-390.
[22] Finn OJ.Cancer Immunology. N Engl J Med 2008;358:2704-2715.
[23]Aguirre-Ghiso JA. Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 2007;7(11):834-846.
[24] Koebel CM, Vermi W, Swann JB, et al. Adaptive immunity maintains occult cancer in an equilibrium state. Nature 2007;450:903-907.
[25] Morse MA, Clay TM, Lyerly HK. Current status of adoptive immunotherapy of malignancies. Expert Opin Biol Ther. 2002;2(3):237-247.
[26]Georgopoulos NT, Merrick A, Scott N, Selby PJ, Melcher A, Trejdosiewicz LK. CD40-mediated death and cytokine secretion in colorectal cancer: A potential target for inflammatory tumour cell killing. Int J Caner 2007;121:1373.
[27]Tong AW, Papayoti MH, Netto G, Armstrong DT, Ordonez G, Lawson JM, Stone MJ. Growth-inhibitory effects of CD40 ligand (CD154) and its endogenous expression in human breast cancer. Clin Cancer Res 2001;7:691.
[28]Har-Noy M, Zeira M, Weiss L et al. Allogeneic CD3/CD28 cross-linked Th1 memory cells provide potent adjuvant effects for active immunotherapy of leukemia/lymphoma. Leuk Res 2009;33:525-38.
[29] Schuler G, Schuler-Thurner B, Steinman RM. The use of dendritic cells in cancer immunotherapy. Curr Opin Immunol 2003;15:138–147
[30] Denzer K, Kleijmeer MJ, Heijnen HF, Stoorvogel W, Geuze HJ. Exosome: from internal vesicle of the multivesicular body to intercellular signaling device. J Cell Sci. 2000;113:3365–3374.
[31] Morse MA, Garst J, Osada, et al. A phase I study of dexosome immunotherapy in patients with advanced non-small cell lung cancer J Transl Med. 2005; 3: 9.
[32] Banchereau J, Briere F, Caux C, et al. Immunobiology of dendritic cells. Annu Rev Immunol 2000;18:767–811.
[33] Hsu FJ, Benike C, Fagnoni F et al. Vaccination of patients with B-cell lymphoma using autologous antigen-pulsed dendritic cells. Nat Med 1996;2:52-55.
[34] McKarney I.Sipuleucel-T (Provenge): active cellular immunotherapy for advanced prostate cancer. Issues Emerg Health Technol. 2007;(101):1-4.
[35] Small EJ, Schellhammer PF, Higano CS, et al. Placebo-controlled phase III trial of immunologic therapy with sipuleucel-T (APC8015) in patients with metastatic, asymptomatic hormone refractory prostate cancer. J Clin Oncol. 2006;24(19):3089-94.
[36]Avigan DE, Vasir B, George DJ, et al. Phase I/II study of vaccination with electrofused allogeneic dendritic cells/autologous tumor-derived cells in patients with stage IV renal cell carcinoma. J Immunother. 2007;30(7):749-61
[37] Bradbury PA, Shepherd FA.Immunotherapy for lung cancer. J Thorac Oncol. 2008;3(6 Suppl 2):S164-70.
[38] Anti-tumor preventative effect of mono-therapy with the use of proteus vaccine, Staphylococcus antitoxin and divaccine of Staphylococcus-proteus. Georgian Med News. 2008 ;(155):49-51).
[39] Grange JM, Bottasso O, Stanford CA, Stanford JLThe use of mycobacterial adjuvant-based agents for immunotherapy of cancer. Vaccine. 2008 Jul 11.
[40]Shahabi V, Reyes-Reyes M, Wallecha A, Rivera S, Paterson Y, Maciag PDevelopment of a Listeria monocytogenes based vaccine against prostate cancer. Cancer Immunol Immunother. 2008;57(9):1301-13.
[41] Maletzki C, Linnebacher M, Kreikemeyer B, Emmrich J.Pancreatic cancer regression by intratumoural injection of live Streptococcus pyogenes in a syngeneic mouse model. Gut. 2008;57(4):483-91.
[42] Henry CJ, Downing S, Rosenthal RC, et al.Evaluation of a novel immunomodulator composed of human chorionic gonadotropin and bacillus Calmette-Guerin for treatment of canine mast cell tumors in clinically affected dogs. Am J Vet Res. 200; 68(11):1246-51.
[43] Patel PM, Sim S, O~Donnell DO, Protheroe A, Beirne D, Stanley A, Tourani JM, Khayat D, Hancock B, Vasey P, Dalgleish A, Johnston C, Banks RE, Selby PJ.An evaluation of a preparation of Mycobacterium vaccae (SRL172) as an immunotherapeutic agent in renal cancer. Eur J Cancer. 2008;44(2):216-23.
[44]Stanford JL, Stanford CA, O~Brien ME, Grange JM.Successful immunotherapy with Mycobacterium vaccae in the treatment of adenocarcinoma of the lung. Eur J Cancer. 2008;44(2):224-7.
[45] Rosenberg SA; Medscape.Cell transfer immunotherapy for metastatic solid cancer-what clinicians need to know. Nat Rev Clin Oncol. 2011;8(10):577-85.
[46]Brown N, Panksepp J.Low-dose naltrexone for disease prevention and quality of life. Med Hypotheses. 2009;72(3):333-7.
[47]Berkson, BM, Rubin D, and Berkson AJ (2006) "Long term survival of a 46 year old man with pancreatic cancer and liver metastases and treated with intravenous alpha lipoic acid and low dose naltrexone.Integrat Cancer Ther 2006;5:83-89.
[48]Berkson, BM, Rubin D, and Berkson AJ (2007) "Reversal of signs and symptoms of a B-cell lymphoma in a patient using only low-dose naltrexone.Integrat Cancer Ther 2007;;6(3):293-296.
[49]Zagon IS, McLaughlin PJ, Naltrexone prolongs the survival time of mice treated with neuroblastoma, Life Sci 1981;28:1095-1102
[50]Serda RE, Godin B, Blanco E, Chiappini C, Ferrari M.Multi-stage delivery nano-particle systems for therapeutic applications. Biochim Biophys Acta. 2011 Mar;1810(3):317-29
[51]Nakayama M, Okano T [Drug delivery systems using nano-sized drug carriers].[Article in Japanese] Gan To Kagaku Ryoho. 2005;32(7):935-40.
[52]Kim SH, Tan JP, Fukushima K, Nederberg F, Yang YY, Waymouth RM, Hedrick JL Thermoresponsive nanostructured polycarbonate block copolymers as biodegradable therapeutic delivery carriers. Biomaterials. 2011 Aug;32(23):5505-14.
.[53] Roy, A., Lahiri, et al. B. Immunologic and survival studies in mice immunized with cryodestroyed ascites fibrosarcoma (AFS) cells. Ind J Exp Biol,1990,28: 1026-1030
[54]Urano M,Tanaka C,Sugiyama Y, et al. Antitumor effects of residual tumor after cryoablation:the combined effect of residual tumor and a protein-bound polysaccharide on multiple liver metastases in a murine model. Cryobiology, 2003,45:238~245
[55] Allen PJ, D~Angelica M, Hodyl C, et al. The effects of hepatic cryosurgery on tumor growth in the liver. Am Surg Res, 1998,77:132-136
[56]Ablin RJ, Soanes WA, and Gonder MJ. Elution of in vivo bound antiprostatic epithelial antibodies following multiple cryotherapy of carcinoma of prostate. Urology, 1973;2:276-279
[57]Soanes WA, Gonder MJ, and Ablin RJ.A possible immuno-cryothermic response in prostatic cancer. Clin Radiol, 1970;21:253-255
[58]Gage AA. Cryosurgery for oral and pharyngeal carcinoma. Am J Surg, 1969;118:669-672
[59]Suzuki Y. Cryosurgical treatment of advanced breast cancer and cryoimmunological responses. Skin Cancer, 1995;10:19-26
[60]Tanaka S. Cryosurgery for malignant melanoma. in: Korpan NN. ed. Basics of Cryosurgery. WeinNewYork:Springer-Verlag,2001:289-293
[61] Zhou XD,Tang ZY.Cryotherapy for primary liver cancer .Semin Surg Oncol, 1998; 14 (2)171-174.
[62]徐克成,胡以則,牛立志.原發性肝癌. 見:徐克成,牛立志.主編.腫瘤冷凍治療學.上海:上海科技教育出版社.2007:169-188
[63]Xu KC,Niu LZ,He WB, et al. The combined treatment of percutaneous cryoablation and ethanol ablation for unresectable large hepatocellular carcinoma. TCRT 2007;6:455-456
[64]Sequential use of transarterial chemoembolization- percutaneous cryosurgery for the treatment of hepatocellular carcinoma. TCRT 2007;6:459-460
[65]Ke-Cheng Xu, Li-Zhi Niu, Wei-Bing He, Yi-Zi Hu, Jian-Sheng Zuo. Percutaneous cryosurgery for the treatment of hepatic colorectal metastases. World J Gastroenterol 2008; 14(9): 1430-1436
[66]Ke-Cheng Xu, Li-Zhi Niu, Yi-Ze Hu, Wei-Bing He, Yi-Song He, Ying-Fei Li, Jian-Sheng Zuo.A pilot study on combination of cryosurgery and 125iodine seed implantation for treatment of locally advanced pancreatic cancer. World J Gastroenterol 2008; 14(10): 1603-1611
[67]Xu KC,Niu LZ, He WB,et al.Percutaneous cryoablation for patients with advanced non-small cell lung cancer.TCRT 2007;6:451-452
[68]Tanaka S. Cryosurgery for advanced Breast Cancer. in: Korpan NN(ed).Basics of Cryosurgery.WeinNewYork.2001:117-120
[69]Tanaka S. Cryosurgical treatment of advanced breast cancer. Skin Cancer, 1995; 10:9-18
[70]徐克成,牛立志,梁冰.乳腺癌.見:徐克成,牛立志.主編.腫瘤冷凍治療學.上海:上海科技教育出版社.2007:138-156
[71]Nishida H, Yamamoto N, Tanzawa Y, Tsuchiya HCryoimmunology for malignant bone and soft-tissue tumors. Int J Clin Oncol. 2011 Apr;16(2):109-17.